ActiveNews se confruntă cu cenzura pe rețele sociale și pe internet. Intrați direct pe site pentru a ne citi și abonați-vă la buletinul nostru gratuit. Dacă doriți să ne sprijiniți, orice donație este binevenită. Doamne, ajută!
Doamna dr. Geanina Hagima, membră a organizației internaționale Medici pentru Respectarea Eticii Covid și invitată specială a ActiveNews, a tradus pentru cititorii noștri un text publicat pe 3 iulie 2021 de experții Michael Palmer MD, Sucharit Bhakdi MD, Stefan Hockertz PhD. Această expertiză a fost depusă de avocata italiană Renate Holzeisen într-un proces care contestă autorizația UE de utilizare a vaccinului mRNA Pfizer pentru copiii de 12-16 ani. Argumentele aduse aici se referă în mod specific la vaccinul Pfizer, dar se aplică în mod similar vaccinului mRNA ModeRNA. Multe se aplică și vaccinurilor AstraZeneca și Johnson&Johnson, bazate pe adenovector. Este un document foarte valoros, util atât pentru medici, dar relativ ușor de înțeles și de persoane cu minime cunoștințe medicale. În această expertiză se evidențiază numeroasele puncte slabe ale studiului Pfizer pentru adulți, dar mai ales pentru copii, superficialitatea EMA și a FDA în evaluarea acestor studii și în acordarea autorizației de utilizare de urgență, motivele pentru care testele PCR nu sunt de încredere. Când aceste date vin din partea unor profesioniști în domeniu, având rol de experți, ele capătă și mai multă greutate. Documentul poate fi găsit în engleză la această adresă. Îi mulțumim doamnei doctor Geanina Hagima și vă invităm să citiți studiul respectiv în cele ce urmează:
Declarație de expertiză privind administrarea la copii a vaccinului mRNA Comirnaty anti COVID-19
Michael Palmer MD, Sucharit Bhakdi MD, Stefan Hockertz PhD
Această declarație de expertiză a fost depusă de avocata italiană Renate Holzeisen în legătură cu un proces care contestă autorizația UE de utilizare a vaccinului mRNA Pfizer pentru copii de 12 ani și peste. Argumentele aduse aici se referă în mod specific la vaccinul Pfizer, dar se aplică în mod similar vaccinului mRNA Moderna. Multe se aplică și vaccinurilor AstraZeneca și Johnson&Johnson bazate pe adenovector.
Se acordă permisiunea de a partaja și distribui liber acest document în formă neschimbată.
Această expertiză privind utilizarea vaccinului Pfizer COVID-19 (Comirnaty, BNT162b2) la adolescenți este împărțită în trei secțiuni, care se vor ocupa de următoarele întrebări pentru:
1. Este necesară vaccinarea adolescenților împotriva COVID-19?
2. Vaccinul Pfizer COVID-19 este eficient?
3. Vaccinul Pfizer COVID-19 este sigur?
Argumentele prezentate în secțiunea 1 se referă la toate vaccinurile cu COVID-19, în timp ce cele din secțiunile 2 și 3 se aplică în mod specific vaccinului Pfizer.
Secțiunea 1 va arăta că vaccinarea adolescenților COVID-19 nu este necesară, deoarece:
• la această grupă de vârstă boala este aproape întotdeauna ușoară și benignă;
• pentru cazurile clinice rare, tratamentul este ușor accesibil;
• imunitatea naturala la boală este acum larg răspândită, datorită infecției anterioare cu virusul (SARS-CoV-2) sau cu alte tulpini de coronavirus; și
• adolescenții asimptomatici nu transmit boala altor persoane care ar putea avea un risc mai mare de infecție.
Secțiunea 2 va demonstra că afirmațiile privind eficacitatea pe care Pfizer le atașează la vaccinul său și anume eficacitatea de 95% la adulți și 100% la adolescenți sunt:
• înșelătoare, deoarece aceste date se referă la eficacitate relativă, nu absolută, acestea din urmă fiind de ordinul a doar 1%;
• ipocrite, deoarece se referă la un obiectiv de evaluare definit în mod arbitrar, lipsit de sens clinic, întrucât nu s-a demonstrat nici o eficacitate împotriva bolii severe sau a mortalității;
• cu totul frauduloase.
Secțiunea 3 va arăta că profilul de siguranță al vaccinului Pfizer este catastrofal. Se va discuta că:
• Pfizer, EMA și FDA au neglijat sistematic dovezile din studiile preclinice pe animale care au indicat în mod clar pericolele grave ale evenimentelor adverse;
• vaccinul Pfizer a provocat mii de decese în termen de cinci luni de la introducerea sa;
• Agențiile care au acordat autorizația de utilizare de urgență pentru acest vaccin au comis erori și omisiuni grave în evaluările lor privind riscurile cunoscute și posibile pentru sănătate .
Singura concluzie posibilă din această analiză este că utilizarea acestui vaccin la adolescenți nu poate fi permisă și că utilizarea sa ar trebui să fie oprită imediat la toate grupele de vârstă.
1 Vaccinarea adolescenților împotriva COVID-19 nu este necesară
1.1 Ce arată dovezile disponibile? Există mai multe dovezi care arată că vaccinarea adolescenților împotriva COVID-19 nu este necesară.
1.1.1. Rata mortalității în caz de COVID-19 în populația generală este scăzută. Marea majoritate a persoanelor infectate cu COVID-19 se recuperează după o boală minoră, adesea caracterizata prin simptome nespecifice. Potrivit epidemiologului John Ioannidis [1, 2], rata mortalității prin infecție a COVID-19 este de 0,15% până la 0,2% în toate grupele de vârstă , cu valori mai crescute la persoanele în vârstă, în special cele cu comorbidități. Această rată nu depășește valorile observate la gripa, pentru care vaccinarea adolescenților nu este considerată urgentă sau necesară.
1.1.2 COVID-19 are prevalență și severitate deosebit de scăzute la adolescenți. În S.U.A. pana in aprilie 2020, persoanele sub 18 ani reprezentau doar 1,7 % din totalul cazurilor de COVID-19 [3, 4]. În cadrul acestei grupe de vârstă, cele mai severe cazuri au fost observate în rândul sugarilor foarte mici [4]. Acest lucru este în concordanță cu lipsa imunității încrucișate a sugarilor la COVID-19, care, la alte grupe de vârstă, este conferită de expunerea anterioară la coronavirusuri respiratorii umane comune (a se vedea secțiunea 1.2.1). În rândul copiilor puțin mai mari, un sindrom inflamator multisistem specific a fost observat la începutul anului 2020 [5]; foarte probabil, acești pacienți au fost, de asemenea, fara imunitate încrucișată.
În concluzie, nu au fost observate cazuri severe de COVID-19 la cei cu vârsta peste 10 – 18 ani [4]. Acest grup reprezinta doar 1% din cazurile raportate cu COVID 19, dintre care aproape toate au fost foarte ușoare. Astfel, adolescenții sunt expuși unui risc foarte scăzut de a fi afectati de COVID-19. Prin urmare, vaccinarea acestei grupe de vârstă nu este necesară.
1.1.3 COVID-19 poate fi tratat. Numeroși medici cu experiență au colaborat la stabilirea unor ghiduri eficiente privind tratamentul pentru COVID-19 manifest clinic [6]. Opțiunile de tratament sunt disponibile atât pentru stadiul incipient al bolii, în care se pune accentul pe inhibarea replicării virale, cât și pentru etapa ulterioară, in care tratamentul antiinflamator este primordial. Două medicamente care au fost utilizate cu succes în stadiul incipient sunt hidroxiclorochina și ivermectina. Ambele medicamente au fost și continuă să fie în uz si împotriva altor boli. Ivermectina, de exemplu, este considerată suficient de sigură pentru a fi utilizată nu numai pentru tratamentul scabiei – o infecție parazitară a pielii ceeste foarte neplacuta insa fara a fi severă – ci chiar profilactic în contactele asimptomatice ale persoanelor infectate cu scabie [7].
Ivermectina este, de asemenea, utilizata pe scară largă în tratamentul bolilor parazitare tropicale, cum ar fi oncocercoza (cunoscuta si sub numele de cecitatea raurilor) și, din acest motiv, este pe lista OMS de medicamente esențiale. Cu toate acestea, in contextul COVID-19, OMS consideră de cuviință să avertizeze împotriva utilizării acestui medicament foarte cunoscut și sigur [8]. Această politică nu poate fi justificată rațional si a fost promovata de autoritățile naționale sau regionale de sănătate și de medicii din întreaga lume.
Disponibilitatea unui tratament eficient anulează justificarea utilizării de urgență a vaccinurilor pe toate grupele de vârstă, inclusiv la adolescenți.
1.1.4 Majoritatea oamenilor, mai ales adolescenții, au devenit până acum imuni la SARS-CoV-2. Din cauza numeroaselor deficiențe ale metodelor de diagnostic utilizate in prezent (a se vedea secțiunea 1.2), este imposibil să se determine cu exactitate proporția celor care au fost deja infectați cu SARS-CoV-2. Cu toate acestea, există indicii că proporția celor care s-au infectat și s-au vindecat este ridicată:
• Incidența sindromului inflamator multisistemic la copii (a se vedea secțiunea 1.1.2) a atins varful maxim la începutul – până la jumătatea anului 2020, apoi a scazut, cu o ușoară întârziere consecutiva valului inițial al bolii respiratorii COVID-19 [9].
• Aproximativ 60% din persoanele de la British Columbia testate aleatoriu au anticorpi detectabili împotriva mai multor proteine SARS-CoV-2 (comunicare personală a lui Stephen Pelech, Universitatea din British Columbia), indicând infecția anterioara cu virusul. Vaccinarea insa, induce anticorpi doar fata de o singură proteină ( spike).
S-a constatat că infecția anterioară COVID-19 protejează foarte eficient de reinfecție [10], iar imunitatea umorală și celulară specifică puternică este detectată la aproape toate persoanele recuperate precum și la cei care au rămas asimptomatici pe tot parcursul infecției [11]. Astfel, o mare parte din populatia din toate grupele de vârstă, inclusiv adolescenții, au deja imunitate specifică și fiabilă la COVID-19. După cum s-a menționat mai sus, majoritatea celor care nu au o astfel de imunitate specifică este totuși protejata de forma grava a bolii prin imunitate încrucișată [12, 13]. Această imunitate va fi deosebit de eficientă la adolescenții sănătoși și adulții tineri. Persoanele cu imunitate specifică sau cu imunitate încrucișată suficientă nu au nici un beneficiu dintr-o vaccinare experimentală .
1.1.5 Transmiterea asimptomatică a COVID-19 nu este reală. Un raționament utilizat frecvent pentru vaccinarea persoanelor care nu sunt expuse riscului de boală severă este necesitatea de a induce ” imunitatea turmei „. Puținele persoane care au un risc ridicat ar trebui protejate prin prevenirea răspândirii virusului în populația generală.
O parte a acestui raționament este ideea de ” răspândire asimptomatică”- persoanele care au fost infectate, dar care nu prezintă semne de boala ci doar un test PCR pozitiv, se presupune că transmit această infecție altor persoane susceptibile. Dacă acceptăm ideea unei astfel de răspândiri asimptomatice, atunci vaccinarea în masă in scop de preventie ar putea apărea într-adevăr ca singurul mijloc de protecție fiabilă a celor expuși riscului .
Cu toate acestea, s-a stabilit fără echivoc că o astfel de transmitere asimptomatică nu are loc. Într-un studiu la scară largă, care a implicat aproape 10 milioane de rezidenți chinezi, nu au putut fi depistate noi infecții la persoanele care au fost testate pozitiv pentru SARSCoV-2 prin PCR, dar care nu au prezentat alte semne de infecție [14]. Aceste rezultate sunt in acord cu mai multe studii care au comparat PCR cu izolarea virusului în cultura celulară în rândul pacienților cu boală acută covid-19 . În toate cazurile, creșterea virusului în cultura celulară a încetat cand simptomele au scăzut sau foarte curând după aceea, în timp ce PCR a rămas pozitiv timp de săptămâni sau luni [15, 16]. În consecință, s-a propus utilizarea culturii celulare, mai degrabă decât a PCR-ului, pentru a evalua infecțiozitatea și pentru a determina durata izolării [16].
Aceste constatări indică faptul că restricționarea contactului persoanelor la risc cu cei care prezintă sau au prezentat foarte recent simptome de boală respiratorie acută ar fi eficientă și suficientă ca măsură de protecție. Prin urmare, vaccinările în masă fără discriminare ale persoanelor care nu sunt ele însele expuse riscului de boală severă, nu sunt necesare pentru a obține o astfel de protecție.
1.2 Dovezi lipsă : utilizarea unor metode inexacte de diagnostic. Un element-cheie care lipsește din discuția actuală cu privire la necesitatea vaccinării este un instrument de diagnosticare fiabil pentru a determina cine este sau nu infectat cu SARS-CoV-2. Procedura de diagnostic cea mai utilizată în acest scop se bazează pe reacția în lanț a polimerazei (PCR). PCR este o metodă foarte puternică și versatilă care are numeroase aplicații în biologia moleculară și, de asemenea, în diagnosticul de laborator al infecțiilor virale. Cu toate acestea, tocmai pentru că este atât de puternic, PCR-ul este foarte dificil de utilizat corect, chiar in conditii ideale; va da rezultate precise doar în mâinile personalului foarte instruit și disciplinat. Utilizarea pe cale larga a acestei metode inseamna ca a fost utilizata de personal neinstruit și insuficient supravegheat. În astfel de circumstanțe, fabricarea în masă a rezultatelor fals-pozitive din cauza contaminării încrucișate a eșantioanelor este un dezastru care era de asteptat să se întâmple (a se vedea pentru exemplu [17]). În timp ce doar acest lucru este deja un motiv de îngrijorare gravă, problemele încep chiar mai devreme – și anume, cu proiectarea testelor PCR și ghidurile utilizate pentru interpretarea lor, care ar duce la rezultate fals pozitive, chiar și în mâinile lucrătorilor calificați și harnici .
Concluzia cheie din această secțiune va fi că testele PCR care au fost utilizate pe tot parcursul pandemiei și care continuă să fie utilizate, nu au acuratețe și specificitate și nu pot fi invocate în scopuri diagnostice sau epidemiologice. Pentru a justifica în mod adecvat aceste concluzii, trebuie mai întâi să analizam elementele de bază ale metodei mai în detaliu.
1.2.1 Coronavirusuri și SARS-CoV-2. Coronavirusurile sunt o familie mare de virusuri cu anvelopa , cu ARN cu lant pozitiv . La om și o varietate de specii de animale, ele provoacă infecții ale tractului respirator care pot varia ca severitate de la ușoare la letale. Vasta majoritate a infecțiilor cu coronavirus la om provoacă boli ușoare ( răceală comună), deși la copiii foarte mici , care nu au imunitate față de expunerea anterioară, boala respiratorie poate fi mai severă. Rețineți că aceeași simptomatologie clinică este de asemenea cauzată de virusuri din alte cateva familii, predominant rinovirusuri. Trei sindroame clinice – SARS, MERS și COVID-19 – sunt asociate cu tulpini specifice de coronavirus care au apărut în ultimii 20 de ani.
Virusul care cauzează COVID-19 este cunoscut sub numele de Sindromul respirator sever acut 2 (SARS-CoV-2). Organizația Mondială a Sănătății (OMS) a declarat epidemia o urgență de sănătate publică de interes internațional la 30 ianuarie 2020 și pandemia la 11 martie 2020. Deși s-a susținut că SARS-CoV-2 a apărut în mod natural la o specie de lilieci [18], o analiză aprofundată a secvențelor genomului SARS-CoV-2 și a tulpinilor de virus asociate indică fără echivoc faptul că virusul este, de fapt, de origine artificială [ 19-22]. Inițial prezentata ca o ” teorie a conspirației „, această explicație a câștigat recent și tardiv acceptarea de catre majoritatea populatiei.
1.2.2 Reacția în lanț a polimerazei . Reacția în lanț a polimerazei (PCR) este o metodă versatilă pentru replicarea biochimica al acidului dezoxiribonucleic (ADN) in vitro. Imediat după inventarea sa de către Kary Mullis în anii 1980, PCR a luat cu asalt lumea biologiei moleculare, realizandu-se aplicații pentru crearea mutațiilor ADN, secvențierea ADN-ului, pentru amestecarea și fuzionarea acizilor nucleic de origine diferită (tehnologia ADN-ului recombinant ) și pentru crearea de noi acizi nucleici sau chiar genomuri întregi de la zero („biologie sintetică”). PCR-ul și-a găsit de curând drumul în domeniul microbiologiei medicale diagnostice [23]. In mod particular, în ceea ce privește agenții patogeni virali, PCR este acum una dintre principalele metode de diagnosticare. În acest context, nu este surprinzător faptul că metodele PCR ar fi trebuit, de asemenea, adoptate în diagnosticul de laborator al SARS-CoV-2.
1.2.2.1 Principiul. Pentru a intelege modul în care funcționează PCR, cel mai bine este să începem cu un fragnent de ADN dublu-helix. Într-o astfel de moleculă, fiecare dintre cele doua lanturi de ADN este constituita din patru molecule (nucleotide), care vor fi denumite aici A, C, G și T. În cadrul fiecărui lant, aceste molecule sunt aranjate ca perlele pe un fir; activitatea biologică și identitatea acidului nucleic vor fi dictate de secvența nucleotidică caracteristică.
Într-o spirală dublu helix a ADN-ului, cele doua lanturi sunt ținute împreună de asocierea corectă a nucleotidelor, astfel încât un A într-un helix este întotdeauna asociat cu un T în celălalt helix, și, de asemenea, C se găsește întotdeauna asociat cu G. Astfel, cunoasterea secvenței nucleotidice a unui lant face posibila cunoasterea celuilalt lant – cele două secvențe sunt complementare.
Primul pas în PCR constă în separarea celor două lanturi, care poate fi efectuată prin încălzirea probei de ADN dincolo de ” punctul său de topire”. Fiecare lant poate fi acum folosit ca șablon pentru sintetizarea unei noi copii a lantului complementar. La capete se adauga două molecule scurte de ADN sintetic („primers”; secvențele lor sunt alese astfel încât să se lege de fiecare dintre componentele șablonului ADN, pe baza complementarității secvenței. Pentru ca această legare să aibă loc, temperatura reacției trebuie scazuta.
Odată ce primerii s-au legat, fiecare molecula este replicata prin încorporarea repetată a precursorilor nucleotidici liberi la unul dintre cele două capete libere. Acest lucru se realizează folosind o polimerază ADN termostabilă – o enzimă bacteriană care sintetizează ADN-ul. Replicarea se efectuează la o temperatură intermediară între cele utilizate pentru separarea dublului helix și legarea primer-ului. După ce acest pas a replicat fiecare din lanturile de ADN, vom obtine dintr-un fragment de ADN dublu helix, două molecule de ADN dublu-helix. Acum putem repeta procesul : separarea cele două fragmente de ADN dublu helix și obtinerea de patru, apoi opt fragmente ADN, și așa mai departe. După 10 cicluri – cantitatea inițială de ADN dublu-helix va fi marita de aproximativ o mie de ori – după 20 de cicluri de un milion de ori – și așa mai departe – amplificarea continuand exponențial cu numărul de cicluri de reacție – până când reacția rămâne în cele din urmă fără primeri și/sau nucleotide precursoare.
1.2.2.2 Testul PCR si moleculele de ARN . În timp ce discuția de mai sus se referea doar la ADN, PCR-ul poate fi utilizat și pentru fragmente de ARN; acest lucru este important pentru SARS-CoV-2, deoarece acest virus are ARN, in loc de ADN ca material genetic. De aceea, ARN-ul este mai întâi convertit (” transcris invers „) în ADN, folosind o enzimă numita transcriptază inversă. Copia ADN a genomului ARN-ului viral este denumită ADN complementar (cDNA).
1.2.3 Capcanele potențiale ale PCR în aplicațiile de diagnosticare . Tocmai am văzut că PCR ne permite să luăm un eșantion foarte mic de ADN și să-l amplificăm cu o eficiență extraordinară. Cu toate acestea, această eficiență a amplificării creează o serie de probleme care trebuie abordate cu atenție pentru a obtine un rezultat semnificativ, în special in conetxtul stabilirii unui diagnostic.
1. Dacă folosim un număr prea mare de cicluri de multiplicare, vor fi detectate cantități minuscule de acizi nucleici care nu au semnificație diagnostică .
2. Diferitele temperaturi utilizate în reacție trebuie calibrate cu atenție și trebuie să corespundă lungimii și secvenței nucleotidice ale celor doi primeri ADN. Dacă, de exemplu, temperatura pentru atasarea primer-ului este prea scăzută, atunci primerii se pot lega de fragmentul de ADN într-un mod nespecific – în ciuda nepotrivirii pentru una sau mai multe nucleotide – si pot fi amplificate alte molecule de ADN decât cele dorite. În contextul diagnosticării COVID, acest lucru ar putea însemna că, de exemplu, acizii nucleici ai altor coronavirusuri decât SARS-CoV-2 sunt amplificați și confundați cu cel din urmă.
3. De asemenea, in afară de temperatură, alte condiții trebuie calibrate cu atenție pentru a asigura specificitatea. Acestea includ, în special, concentrațiile de ioni de magneziu și de nucleotide libere; concentrațiile excesiv de mari favorizează amplificarea nespecifică.
Există o altă problemă care rezultă nu din eficiența amplificării, ci mai degrabă dintr-o limitare tehnică: PCR este cel mai eficient dacă molecula de ADN amplificată nu este mai mare de câteva sute de nucleotide în lungime; cu toate acestea, un genom coronavirus de lungime completă are aproximativ 30.000 de nucleotide lungime. Prin urmare, amplificarea cu succes a unui segment de doar câteva sute de nucleotide, nu dovedește că a existat initial fragmentul intact de ARN viral și, prin urmare, ca acesta a făcut parte dintr-o particulă de virus infecțios .
1.2.4 Precauții tehnice pentru diagnosticul prin PCR. Amplificarea nespecifică sau prea sensibilă poate fi prevenita în mai multe moduri:
1. Toti primerii care fac parte din kitul de test trebuie să fie proiectati astfel încât să se lege de fragmentul de ADN de testat la aceeași temperatură. Asa cum poate fi intuit, un primer mai lung va începe sa se ataseze la șablonul său la o temperatură mai mare decât unul mai scurt; de asemenea, întrucât legătura care se formează între C și G pe lanturile opuse este mai strânsă decât cea dintre A și T, trebuie luată în considerare și compoziția nucleotidică a fiecărui primer. Dacă primerii sunt diferiti, atunci primerul cu legare mai avidă va începe să se lege non-specific atunci când temperatura este suficient de scăzută pentru a permite celuilalt primer să se lege în mod specific. Protocolul original Corman-Drosten PCR [24] care a fost aprobat rapid de OMS, a fost criticat pentru exact această greșeală [25].
2. În loc de a amplifica doar un singur fragment al lantului de ADN-ului, unii pot amplifica simultan mai multe fragmente, folosind numărul corespunzător de perechi de primeri ADN , și stipulează că toate piesele, sau un număr minim adecvat, trebuie să fie amplificate cu succes pentru ca testul să fie catalogat ca pozitiv.
3. Trebuie ținuta evidența „pragului ciclurilor” de amplificare, sau a valorii Ct pe scurt, adică a numărului de cicluri de amplificare care au fost necesare pentru a produce o cantitate detectabilă de produs amplificat; cu cât este mai mic numărul de cicluri, cu atât este mai mare cantitatea inițială de fragmente de acizi nucleici care a fost prezentă in proba.
4. Confirmarea identității – secvența nucleotidică exactă – a moleculelor de acid nucleic care au fost amplificate. Secvențierea ADN-ului a fost fezabilă de rutină în laboratoarele de diagnosticare pentru o perioadă considerabilă de timp și nu există nici un motiv să nu fie utilizata, în special atunci când deciziile referitoare la sănătatea publică depind de aceste rezultate de laborator .
1.2.5 PCR în timp real. Al treilea punct de mai sus, și într-o măsură al patrulea, poate fi abordat folosind PCR în timp real. În această metodă, acumularea ADN-ului amplificat este monitorizată pe măsură ce reacția progresează, în timp real, cu cuantificarea produsului după fiecare ciclu ( PCR cantitativ; qPCR pe scurt). Detectarea în timp real poate fi realizată prin includerea unui al treilea primer de ADN, care se leagă de oricare dintre componentele ADN șablon , într-o locație între ceilalti doi primeri care conduc sinteza ADN-ului. În aval de legarea celui de-al treilea grund, se va emite un semnal luminos, iar intensitatea acestui semnal este proporțională cu cantitatea prezentă de ADN amplificat. Deoarece legarea acestui primer, de asemenea, necesită o secvență țintă complementară pe șablonul ADN , această metodă oferă o confirmare a secvenței nucleotidice a ADN-ului țintă.
O a doua varietate mai simplă de PCR în timp real folosește o moleculă de colorant organic simplu care se leagă de ADN-ul dublu helix. Colorantul afișează fluorescență slabă de fundal care crește dramatic la legarea ADN-ului. Creșterea măsurată a fluorescenței este apoi proporțională cu cantitatea totală de ADN amplificat; dar din moment ce colorantul se leagă indiferent de secvența de ADN, în acest caz semnalul nu confirma că fragmentul corect de ADN a fost amplificat.
1.2.6 Deficiențe ale testelor comerciale PCR COVID-19. Din păcate, numărul de cicluri de amplificare ( valoarea Ct ) necesare pentru a găsi materialul genetic în cauză este rareori inclus în rezultatele trimise autorităților, medicilor și celor testati. Majoritatea testelor RT-qPCR disponibile în comerț stabilesc limita ciclurilor de amplificare până la care un semnal de amplificare trebuie considerat pozitiv la 35 sau mai mare. Mai multe studii au indicat că valorile Ct peste 30 au o valoare predictivă foarte scăzută pentru pozitivarea culturilor de virus și, prin urmare, pentru infecțiozitate sau prezența bolii acute [15, 26-28]. Având în vedere că, în multe studii clinice, inclusiv cele efectuate de Pfizer (vezi mai târziu) — un „caz covid-19” este declarat cand se asociaza un test PCR pozitiv, indiferent de valoarea Ct , cu unul sau mai multe simptome nespecifice de boala respiratorie, valorile prea mari ale Ct nu trebuie supraestimate. Această eroare sistematica si frecventa a fost suficientă pentru a denatura grav diagnosticele pacienților, precum și intreaga epidemiologie a pandemiei.
O altă neglijență sistematică se referă la verificarea identității fragmentelor de ADN amplificate. În timp ce secvențierea Sanger a ADN-ului pentru astfel de fragmente, considerata standardul de aur, este fezabilă pe scară largă, ea nu a fost utilizată în mod obișnuit în campaniile de testare PCR în masă. Eroarea este agravată de numărul foarte mic de amplificări independente PCR considerate suficiente pentru un test pozitiv, in numar de doua, sau chiar doar una în diferite jurisdicții, precum și de diverse alte probleme tehnice în protocolul Corman-Drosten adoptat și comercializat pe scară largă, care au fost discutate în detaliu în altă parte [ 25].
Pe scurt, un rezultat pozitiv al testului RT-qPCR nu poate fi acceptat ca dovadă a faptului că persoana în cauză este infectată și infecțioasă – chiar dacă există plauzibilitate clinică rezonabilă a infecției reale cu COVID-19 , precum și o prevalență comunitară semnificativă a bolii. În primul rând, materialul ARN care conține secvențele țintă ar putea apartine virusului neviabil/inactiv; acest lucru este foarte probabil dacă pacientul în cauză și-a revenit deja după infecție. În al doilea rând, trebuie să existe o cantitate minimă de virus viabil pentru transmitere; dar testele efectuate cu valori Ct excesiv de mari (si nedeclarate) vor detecta cantități minuscule de material genetic care nu prezintă nici un risc real.
2 Vaccinul Pfizer COVID-19 nu are eficacitate
2.1 Ce arată dovezile? Pfizer afirma in mod persistent eficacitatea de 95% a vaccinului său, pe baza studiilor clinice care au stat la baza aprobărilor de urgență acordate de FDA [29] și Uniunea Europeană [30]. Într- un studiu mai recent efectuat pe adolescenți [31], eficacitatea a fost afirmata a fi de nu mai puțin de 100%. Cu toate acestea, respectivele afirmații nu pot fi acceptate la valoarea nominală.
2.1.1. Eficacitate absolută vs. relativă. În primul studiu clinic raportat al Pfizer/BioNTech, 43548 de participanți au fost randomizati, dintre care 43448 au primit injecții – 21720 persoane au primit vaccinul experimental (BNT162b2), iar 21728 au primit placebo. In ambele grupuri, au fost înregistrate în total 170 de cazuri de COVID-19, dintre care 162 au fost în grupul placebo, iar 8 în grupul BNT162b2. Pe baza acestor calcule 8/162≈5%- Pfizer a afirmat eficacitstea de 95%. Cu toate acestea, în mod evident, această eficacitate este doar o valoare relativă, în termeni absoluți, mai puțin de 1% din grupul placebo dezvoltand COVID-19 și, prin urmare, mai puțin de 1% din grupul vaccinat a fost protejat de acesta.
Situația este similară cu studiul efectuat ulterior, la o scara mult mai mica, pe adolescenți cu vârsta între 12 și 15 ani [31]. Aici, grupul vaccinat a cuprins 1131 de persoane, în timp ce grupul placebo a inclus 1129 de persoane. În grupul din urmă, 16 persoane au fost diagnosticate ulterior cu COVID-19, în timp ce în grupul vaccinat nu au apărut cazuri. Si in acest studiu, Pfizer/BioNTech, in loc sa calculeze si sa prezinte eficacitatea absolută de 1,4% , au afirmat-o in concluzii doar pe cea relativă de 100%; doar această ultimă valoare este evidențiată în abstractul studiului publicat .
2.1.2 Impactul negativ al BNT162b2 asupra morbidității globale la adolescenți. În studiul citat pe adolescenți, un „caz” de COVID-19 a fost afirmat după cum urmează:
Definiția COVID-19 confirmată a inclus prezența ≥1 simptom (de exemplu, febră, tuse nou aparuta sau intensificata, dificultăți de respirație nou instalate sau intensificate, frisoane, dureri musculare nou aparute sau intensificate, pierderea gustului sau mirosului, durere în gât, diaree, vărsături) și un test SARS-CoV-2 PCR-pozitiv în timpul, cu 4 zile inainte sau după perioada simptomatică (efectuat fie la laboratorul central, fie la un laborator de testare local și utilizând un test acceptabil).
Astfel, un singur simptom dintr-o listă de simptome necaracteristice, plus un test pozitiv ce nu este de incredere (cf. Secțiunea 1.2.6), au fost considerate suficiente pentru a stabili diagnosticul. În timp ce studiul continuă să enumere mai multe criterii clinice de boală severă, el nu indica ca vreo persoană testată a prezentat unul dintre aceste criterii. Prin urmare, se poate observa ca au fost foarte puține cazuri non-severe și nici un caz clinic sever de COVID-19 in întreaga populație de testare .
În contrast evident cu procentul mic de adolescenti cu COVID (forme usoare si medii), efectele secundare ale vaccinării au fost extrem de frecvente. În afară de durerea la locul injectării care apare la un procent ridicat din grupul vaccinal (79% până la 86%), oboseala (60% până la 66%) și cefaleea (55% până la 65%) sunt foarte frecvente. Oboseala severă și durerile de cap au fost raportate la cateva procente dintre persoanele vaccinate. Cefaleea severă, în special, poate fi asociată cu evenimente trombotice subiacente (vezi pct. 3.1.3.2). Prin urmare, este clar că, dacă luăm în considerare atât efectele adverse ale COVID-19, cât și cele ale vaccinului, morbiditatea globală a fost mult mai mare la cei vaccinați decât la grupul placebo.
2.1.3 Afirmații puțin probabile și contradicții în dovezile Pfizer privind eficacitatea.
Am văzut mai sus că eficacitatea raportată a vaccinului Pfizer este foarte modestă atunci când este exprimată în termeni absoluți. Cu toatea cestea, nici măcar această eficacitate scăzută nu poate fi acceptată la valoarea nominală. Acest lucru reiese din rapoartele de evaluare întocmite de FDA [29] și EMA [30].
2.1.3.1 Instalarea bruscă a imunității în ziua 12 după prima injectare. O ilustrare esentiala care apare în ambele rapoarte compară incidența cumulativă a COVID- 19 în rândul grupului vaccinat și al grupului placebo. Acest grafic, care este prezentat ca figura 9 în raportul EMA, este reprodus aici în figura 1B. Până în ziua 12 după prima injecție, incidențele COVID cumulate în cele două grupuri sunt asemanatoare. Totusi, dupa ziua 12, numai grupul placebo continua sa acumuleze in mod constant noi cazuri, in timp ce curba cazurilor pentru cei vaccinati scade aproape la zero.
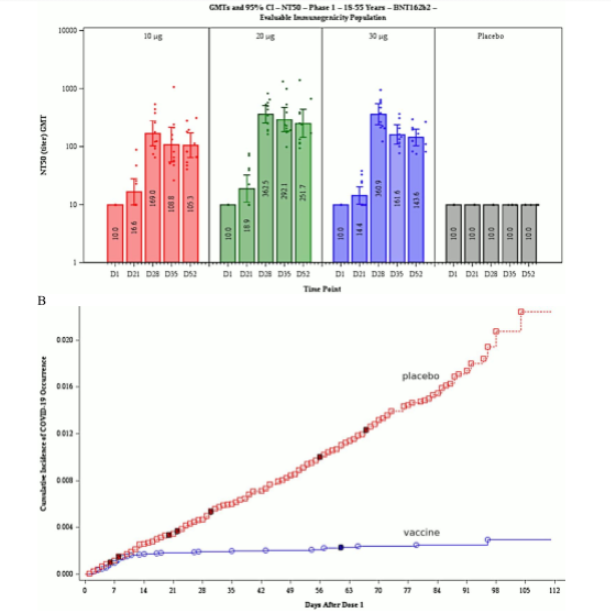
Figura 1 Reproducerea figurii 7 (A; titrurile de anticorpi neutralizanti în diferite zile după prima injecție) și a figurii 9 (B; incidența cumulativă a COVID-19 în rândul grupurilor vaccinate și placebo ) din raportul de evaluare EMA [30]. Notă axa logaritmică y în B. Consultați textul pentru discuții.
Această observație remarcabilă sugerează că imunitatea se instalează foarte brusc și uniform în ziua 12 exact printre vaccinați. Deoarece a doua injecție a avut loc la 19 sau mai multe zile după prima, acest lucru ar însemna că o injecție este suficientă pentru a stabili imunitatea completă. Cu toate acestea, această concluzie nu este precizată și, de fapt, Pfizer nu raportează deloc date privind persoanele testate cărora li s-a administrat o singură injecție.
Un debut brusc al imunității complete în ziua 12 după prima expunere la antigen nu este deloc un rezultat plauzibil din punct de vedere biologic. De obicei, imunitatea se dezvoltă mai lent și treptat; și un astfel de model este, de fapt, raportat pentru același vaccin (BNT162b2) în figura 7 din raportul EMA, reprodus aici ca figura 1A. Datele arată creșterea anticorpilor neutralizanți la SARS-CoV-2 în funcție de timpul ce a trecut după prima injectare a vaccinului.
Tabelul 1 Subiecți fără dovezi de infecție în grupurile cu administrare de vaccin și placebo în diferite momente ale studiului clinic. Date extrase din tabelul 4 din [30]. Consultați textul pentru discuții.

Inducerea anticorpilor neutralizanți este scopul declarat al vaccinului Pfizer. În general, anticorpii sunt molecule proteice produse de sistemul nostru imunitar atunci când întâlnesc antigenele – macromolecule care nu apartin corpului nostru . Antigenele sunt adesea fragmente de microbi, inclusiv virusuri. Un anticorp se leagă de o portiune specifică de pe suprafața antigenului; această portiune se numește epitopul anticorpului în cauză.
În contextul infecțiilor virale, anticorpii pot fi neutralizanți sau non-neutralizanți. Un anticorp neutralizant recunoaște un epitop care este esențial pentru funcționarea virusului. Acel fragment care este si epitop este de asemena utilizat pentru ca virusul sa se lege de o zona receptor de pe suprafața celulei gazdă in care virusul trebuie să patrunda pentru a se replica. Anticorpii non-neutralizanti recunosc o zona caracteristică de pe suprafața virusului (epitop) care nu joacă vreun rol esențial în infecțiozitatea virusului.
Având în vedere cele de mai sus, trebuie să ne așteptăm ca nivelul sanguin al anticorpilor neutralizanti să reflecte gradul de imunitate clinică la virus. Acest lucru nu este insa reflectat de ceea ce vedem în figura 1A. În ziua 21 după prima injecție, adică la 9 zile după presupusul debut brusc al imunității clinice complete, cantitatea de anticorpi neutralizanți din sânge abia a crescut peste nivelul de baza.
Nivelul maxim de anticorpi neutralizanți se observă in ziua 28 după prima injecțare, moment în care majoritatea persoanelor testate au fost deja injectate cu a doua doza. Evolutia in timp a imunitatii celulare (prin celule T) nu a fost raportata, dar în absența unor dovezi care sa indice contrariul se poate presupune că seamănă cu cea a răspunsului prin anticorpi.
Este foarte dificil să se gaseasca o explicatie pentru cele doua situatii contradictorii: debut brusc al imunității clinice complete în ziua 12, in timp ce anticorpii neutralizanți apar câteva săptămâni mai târziu. Cu toate acestea, nici recenzorii EMA, nici cei ai FDA nu au parut interesați de aceasta discordanta.
2.1.3.2 Documentația Pfizer se contrazice asupra incidența COVID-19 după vaccinare. Tabelul 1 enumeră procentele subiecților din grupul vaccinal și din grupul placebo care nu au prezentat dovezi de infecție cu SARS-CoV-2 în ziua 0 (înainte de prima doză) și în ziua 14 după a doua doză. Observam ca intre cele doua momente, 7,5% dintre subiecții din grupul vaccinat și 8% dintre cei din grupul control s-au infectat.
Conform cu [29], a doua doză a fost administrată la aproximativ 21 de zile după prima, deși toti subiecții care au primit-o între zilele 19 și 42 după prima injecție au fost incluși în evaluare. Dacă luăm ziua 35 după prima injecție ca momentul aproximativ al comparației, vedem din Figura 1B că incidența cumulativă între ziua 0 și ziua 35 este de peste două ori mai mare în grupul placebo decât în grupul vaccinat; insa din Tabelul 1, vedem că incidenta este aproape la fel. În plus, in ambele grupuri numerele sunt substanțial mai mari în tabel decât în figura.
Aceste două seturi de date nu pot fi reconciliate; unul trebuie să fie fals. Așa cum s-a discutat, debutul brusc al imunității din figura 1B nu este plauzibil, cel mai probabil este ca acest set de date să fi fost fabricat.
Tabelul 2 Incidența COVID-19 în rândul subiecților neinfectați anterior, dar vaccinați sau infectați anterior, dar nevaccinați. Date extrase din tabelele 6 și 7 din [29]. A se vedea text pentru discuții.
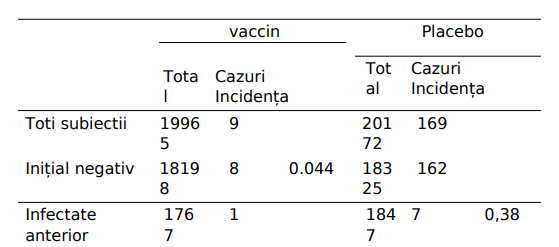
2.1.3.3 Datele Pfizer sugerează că vaccinul protejează mai eficient de COVID decât infecția anterioară cu virusul.
De asemenea, putem examina datele raportate de Pfizer pentru a compara imunitatea conferită de vaccin cu cea indusă de infecția anterioară cu virusul. Datele relevante sunt rezumate în Tabelul 2. Cele 8 cazuri raportate de COVID-19 în rândul persoanelor vaccinate care au fost testate inițial negativ pentru virus determina o incidență de 0,044%. Pfizer raportează, de asemenea, 7 cazuri în rândul persoanelor care au fost testate inițial pozitiv, dar nu au fost vaccinate. Deoarece acest grup este considerabil mai mic, cele 7 cazuri se traduc într-o incidență de aproape de nouă ori mai mare (0,38%).
Este cunoscut faptul că vaccinurile, în cel mai bun caz, se vor apropia de, dar nu vor depăși imunitatea conferită de infecția naturală corespunzătoare. Imunitatea foarte robustă după infecția naturală anterioară cu SARS-CoV-2 a fost raportată recent [10]; în acest studiu, nu s-a observat niciun caz de COVID-19 în rândul a 1359 de persoane care au rămas nevaccinate. Imunitatea robustă după infecție este confirmată și de investigații de laborator [11]. Prin urmare, analiza de mai sus confirmă încă o dată că rezultatele studiului raportate de Pfizer nu pot fi de încredere. Că nici FDA, nici EMA nu a detectat aceste contradictii si , astfel, nu insuflă încredere în ce priveste meticulozitatea și integritatea proceselor lor de revizuire .
2.2 Ce dovezi lipsesc pentru a face cazul? Am menționat deja caracterul inselator, inventat al endpointului utilizat în studiile clinice Pfizer – și anume, numărarea unui „caz” COVID-19 bazat pe nimic mai mult decât un rezultat POZITIV PCR , împreună cu unul sau mai multe elemente dintr-o listă de simptome clinice în mare parte necaracteristice. Prin urmare, trebuie să ne întrebăm dacă vaccinul oferă beneficii consistente, dar din datele prezentate, beneficiul cel mai probabil este de a reduce numărului de cazuri banale.
2.2.1 Prevenirea bolilor severe și a mortalității. Pagina 48 din raportul FDA rezumă raspunsul după cum urmează: „Un număr mai mare de persoane cu risc crescut de COVID-19 ar fi necesar pentru a confirma eficacitatea vaccinului asupra mortalității.”
Observăm că acest citat nu numai că răspunde negativ la întrebarea pusă, dar anuleaza întregul pretext de acordare a autorizației de utilizare de urgență pentru acest vaccin experimental. Dacă într-un studiu care implică 40.000 de persoane, numărul de rezultate fatale este prea mic pentru a permite detectarea oricărui beneficiu al vaccinului, atunci nu există ” urgență” care sa justifice riscurile grave și vătămarea evidentă, asociate cu introducerea exagerat de grăbită a acestor vaccinuri anti COVID19 .
Nu s-au înregistrat deloc decese în studiul efectuat pe adolescenți [31]; și am observat că nici in acest studiu nu s-au raportat cazuri de boală severă. Prin urmare, în această grupă de vârstă nu s-a evidentiat, nici un beneficiu semnificativ si nici o urgență.
2.2.2 Eficacitatea pentru cei cu risc crescut de COVID sever-19. Aici, raportul FDA are acest lucru de spus: „Deși proporția participanților cu risc inalt de COVID19 sever este adecvată pentru evaluarea globală a siguranței în perioada de urmărire disponibilă, pentru anumite subseturi, cum ar fi persoanele imunocompromise (de exemplu, cei cu HIV / SIDA) numaruleste prea mic pentru a evalua eficacitatea .”
Raportul evita sa raspunda la intrebarea privitoare la reducerea riscului în rândul celor cu afecțiuni predispozante mai frecvente, cum ar fi, de exemplu, bolile cardiace sau pulmonare cronice. Cum era de asteptat, studiul clinic pe adolescenți [31] nu oferaconcluzii in aceasta privinta. In general, studiile clinice ale Pfizer nu au prezentat dovezi referitoare la beneficiul clinic al persoanelor cu risc crescut de COVID- 19 sever.
2.2.3 Eficacitatea împotriva efectelor pe termen lung ale bolii COVID-19. Verdictul raportului FDA este următorul: „Vor fi necesare evaluări suplimentare pentru a evalua efectul vaccinului asupra prevenirii efectelor pe termen lung ale COVID-19, utilizand datele din studiile clinice și din urmarirea postautorizare. Cu alte cuvinte, studiile clinice nu au furnizat astfel de dovezi.
2.2.4 Reducerea transmiterii. Pe această temă, raportul FDA afirma că „evaluări suplimentare, inclusiv datele din studiile clinice și din utilizarea vaccinului post-autorizare vor fi necesare pentru a evalua eficacitatea vaccinului in ce priveste prevenirea excretiei și a transmiterii virusului , mai ales la persoanele cu infecție asimptomatică .”
În exprimare mai simpla, nu există dovezi că transmiterea virusului este redusă și, de fapt, studiile nici măcar nu au fost concepute pentru a dovedi sau infirma un astfel de efect.
2.2.5 Durata protecției. Raportul FDA afirmă corect (la pagina 46) că „ca deoarece analizele intermediare și finale au o durată limitată de urmărire, nu este posibil să se evalueze eficacitatea pe o perioadă mai mare de 2 luni.” Chiar dacă alegem să credem ca a fost demonstrată o eficacitate pe perioada de studiu de două luni, o astfel de durată scurtă de protecție nu justifică riscurile asociate vaccinării.
2.2.6 Eforturi inadecvate pentru determinarea dozei optime. Figura 1A arată că nivelul anticorpilor neutralizanți este practic același cu dozele de vaccin (ARNm) de 20 μg și respectiv, 30 μg. Acest lucru ridică întrebarea de ce a fost utilizata doza mai mare – și nu numai la adulții pe care au fost obținute aceste date, ci si la copii, a căror greutate corporală mai mică ar fi trebuit să se insoteasca de o reducere a dozei. În plus, datele din figura 1B sugerează că imunitatea deplină este indusă deja de prima doză; aplicarea celei de-a doua doze nu modifică ritmul de acumulare de cazuri noi în grupul vaccinal și, prin urmare, administrarea celei de-a doua doze nu are nici un efect asupra imunității. Administrarea unei singure doze ar fi redus probabilitatea evenimentelor adverse.
2.2.7 Rezumat. Studiile clinice efectuate de Pfizer nu conțin nici o dovadă a vreunui beneficiu conferit de vaccin pentru criteriile finale, relevante din punct de vedere clinic. Acest lucru se aplică tuturor grupelor de vârstă testate si în particular adolescenților.
3 Vaccinul Pfizer COVID-19 nu este sigur
3.1 Ce arată dovezile? Studiile clinice pentru Comirnaty (BNT162b2), precum și pentru celelalte vaccinuri COVID-19 au fost efectuate in graba într-un timp foarte scurt; acesta însemna că nu au fost luate măsuri de precauție adecvate pentru a asigura siguranța acestora. Cu toatea acestea, experimentele pe animale efectuate înainte de începerea testelor clinice au oferit motive de ingrijorare in ce priveste toxicitatea severă. Din păcate, această ingrijorare a fost confirmata intensiv în practică inca de la începutul vaccinărilor în masă .
3.1.1 Datele preclinice din experimentele pe animale indică un potențial de vătămare gravă. Comirnaty, ca toate celelalte vaccinuri anti -COVID-19 pe bază de gene, provoacă expresia in vivo a unei proteine specifice a SARS-CoV-2, și anume, așa-numita proteină spike, care se află pe suprafața virusului. Proteina spike mediază atasarea initiala a particulei virale de celula gazdă și, de asemenea, intrarea ulterioară a acesteia în celulă. Ideea cheie din spatele vaccinului Comirnaty este după cum urmează:
1. un ARN sintetic care codifică proteina spike alaturi de un amestec de lipide sintetice neutre și cationice (încărcate pozitiv), care se grupează în nanoparticule lipidice (LNP);
2. după injectare, LNP-urile facilitează preluarea mRNA de catre celulele gazda, unde ARNm va determina expresia (sinteza) proteinei spike;
3. proteina spike va apărea pe suprafața celulelor gazdă și va induce o reacție imună fata de ea.
Reacția imună la proteina spike va cuprinde atât anticorpi, care pot fi sau nu neutralizanti (a se vedea secțiunea 2.1.3.1) cat și T-limfocite (celule T). Unele dintre aceste celule T sunt citotoxice (cunoscute și sub numele de celule T killer); funcția lor este de a ucide celulele infectate cu virus.
În timp ce această strategie de vaccinare poate parea utila teoretic, ea are o serie de dezavantaje și riscuri. Acestea se datoresc atat amestecului lipidic, cât și proteinei spike, ambele cu activități toxice cunoscute.
3.1.1.1 Activități toxice și procoagulante ale proteinei spike. Boala COVID19 clinică severă este adesea însoțită de o activare patologică a coagulării sângelui [32]. Este cunoscut rolul central al proteinei spike în această complicație [33]. Există cel puțin două mecanisme diferite pentru declanșarea coagulării sângelui:
1. Dacă proteina spike este exprimată de catre celulele endoteliale vasculare – stratul celular ce captuseste vasele de sânge – reacția imună la proteina spike poate distruge aceste celule. Leziunea vasculară rezultată va activa coagularea sângelui. In acest răspuns imun pot fi implicate atat celulele T citotoxice cat și anticorpii care declanșează sistemul complementului și alte mecanisme imune efectoare.
2. Molecule de proteine Spike care se formează în circulație, sau care intră în circulatie după ce au fost sintetizate în altă parte a corpului, se pot lega direct de trombocite și să le activeze . Aceasta va declansa din nou coagularea sângelui.
Al doilea mecanism este semnificativ, deoarece nu implică o reacție imună; prin urmare, poate fi declanșat imediat chiar și la acele persoane care nu au imunitate preexistentă. Primul mecanism va fi mai evident la cei care au deja imunitate la proteina spike, fie consecutiv infecției cu virusul, fie datorita vaccinarii anterioare. De notat ca mecanismul prin care celulele sunt deteriorate va fi similar și în alte țesuturi – orice celulă din organism care exprimă proteina spike va deveni astfel o țintă pentru sistemul imunitar .
Deoarece Comirnaty și alte vaccinuri pe baza de gene induc sinteza proteinei active și potențial toxice spike, este important să înțelegem modul în care această proteină se distribuie în organism. Toxicitatea poate fi limitată dacă vaccinul și, prin urmare, sinteza proteinei spike rămn la locul injectării, în țesutul muscular, dar în afara circulației. Pe de altă parte, dacă vaccinul intra în fluxul sanguin, atunci ar trebuie să ne așteptăm la expresia proteinei spike în vasele de sânge și toxicitate prin activarea coagulării sângelui.
3.1.1.2 Distributia vaccinului în experimentele pe animale. Asa cum s-a dovedit, vaccinul apare în sânge foarte rapid după injectarea intramusculară. În experimentele pe care Pfizer le-a raportat autorităților de sanatate japoneze [34], șobolanilor li s-a injectat un produs similar vaccinului. Acest material a fost chimic similar cu Comirnaty, dar conținea o moleculă de ARNm care codifica o proteină ușor de urmărit, non-toxică (luciferază) in locul de proteina spike a SARS-CoV-2. Amestecul lipidic folosit pentru a forma LNP-urile a fost identic cu cel din Comirnaty. Una dintre lipidele din acest amestec a fost marcată radioactiv, ceea ce a permis urmărirea și cuantificarea sensibilă și precisă a distribuției probei în organism. S-au făcut mai multe observatii remarcabile:
1. Lipidele radioactive au apărut rapid în sânge. Concentrația plasmatică a atins valoarea maxima după 2 ore; dar chiar și la doar 15 minute de la injectare, nivelul plasmatic ajunsese deja la 45% din această valoare maximă .
2. Niveluri foarte crescute ale lipidelor radioactive s-au acumulat în ficat, splina, glandele suprarenale și ovare.
3. Niveluri relativ scăzute s-au acumulat în sistemul nervos central (creier și măduva spinării).
4. Expresia proteinei luciferaza codificata de ARNm a fost studiată numai în ficat, unde a fost detectată cu ușurință .
3.1.1.3 Mecanismul de absorbție a vaccinului în circulatie. Având în vedere ca LNP-uri ce contin ARNm au dimensiuni moleculare destul de mari , trebuie să ne întrebăm cum au reușit să intre în fluxul sanguin atât de rapid. După injectarea intramusculară, cea mai mare parte a vaccinului ajunge în spatiul „interstițial”, adică in spațiul extracelular din afara vaselor de sânge. Acest spațiu este separat de spațiul intravascular prin bariera capilară, care permite trecerea liberă doar a moleculelor mici, cum ar fi oxigenul sau glucoza, dar este impermeabil la molecule mari, cum ar fi proteinele plasmatice; și particulele din vaccin sunt chiar mai mare decât acestea.
Lichidul din spațiul interstițial este drenat continuu prin sistemul limfatic; tot lichidul limfatic intră în cele din urmă în fluxul sanguin prin canalul toracic. Particulele care sunt prea mari pentru traversarea barierei capilare pot ajunge în cele din urmă in circulație prin intermediul acestui drenaj limfatic. Cu toate acestea, acest proces tinde să fie considerabil mai lent [35] decât a fost observat in cazul simularii cu vaccinul ce contine ARNm pentru luciferaza. Prin urmare, trebuie să ne întrebăm dacă aceast vaccin a determinat ruperea barierei capilare și, prin urmare, a intrat direct în fluxul sanguin.
Amestecuri lipidice similare cu cele conținute în vaccinul Pfizer au fost utilizate experimental pentru a penetra bariera hematoencefalică după injectarea intravenoasă [36]. Bariera hematoencefalică poate fi descrisă ca o „versiune fortificată” a barierei capilare obișnuite – care, dacă poate fi traversata, atunci ne așteptăm la același lucru și in cazul unei bariere capilare obișnuite. Concentrația locală ridicată a nanoparticulelor lipidice care rezulta după injectarea intramusculară va detemina în continuare distrugerea barierei capilare. Rezultatul este că vaccinul va apărea în sânge în cantități mari și în interval scurt. Prin urmare, ne asteptam la complicații datorate coagulării sângelui.
3.1.1.4 Alte indicii ale toxicitatii LNP. Intreruperea barierei capilare de către LNP-uri este cauzata de un efect citotoxic asupra celulelor endoteliale, care reprezinta singurul element celular al pereților capilarelor. Efectele citotoxice ale LNP-urilor sunt, de asemenea, evidente prin deteriorarea fibrelor musculare la locul injectării [30,p.49] și a celulelor hepatice [30,p.46]. Rețineți că aceste date au fost obținute tot cu modelul de vaccin mRNA ce codifica proteina luciferaza presupusa a fi noncitotoxica. Prin urmare, aceste acțiuni citotoxice nu se datorează unei acțiuni directe a proteinei spike. O componentă imuna a afectrii celulare nu poate fi complet exclusă, dar este putin probabil sa fie dominantă în acest caz, deoarece luciferaza, spre deosebire de proteina spike , nu este transportată la suprafața celulei.
3.1.1.5 Mecanismele de acumulare în organe specifice. Ratele ridicate de acumulare a vaccinului în ficat și splină sugerează preluarea sa de către celulele macrofage, care abundă în ambele organele și sunt în general responsabile de inlaturarea resturilor nedorite. Acumularea lipoproteinelor în glandele suprarenale, ovare și, din nou, in ficat evidentiaza particularitatea lipoproteinelor de a fi preluate de catre celulele acestor organe. Lipoproteinele sunt complexe de lipide și molecule proteice specifice (apolipoproteine) care funcționează ca transportori ai lipidelor în sânge. Ficatul are un rol central în metabolismul lipidelor și al lipoproteinelor în general, în timp ce glandele suprarenale si ovarele preiau lipoproteinele pentru a obtine colesterolul, pe care îl convertesc apoi in hormoni steroizi. Un astfel de rol al lipoproteinelor în transportul și preluarea de catre celule a nanoparticulelor lipidice este acceptat [37]. Prin urmare, trebuie să ne așteptăm ca alte organe, cu o rată ridicată de preluare a lipoproteinelor să fie afectate în mod similar. Aceastea includ în special placenta, care, ca si ovarele, produce cantități crescute de hormon steroidian (progesteron) precum și glandele mamare care, pentru lactatie, preiau colesterolul conținut în lipoproteine si il secreta în lapte.
3.1.1.6 Corelatia dintre preluarea lipidelor și expresia ARNm. În studiul experimental mentionat mai sus, s-a demonstrat că ficatul exprimă ARNm care este asociat cu LNP (vezi [30], secțiunea 2.3.2). După cum s-a menționat mai sus, ARNm-ul folosit în acest studiu a codificat enzima licuricilor numita luciferază, care este proteina ce permite acestor insecte să strălucească în întuneric. Țesuturile mamiferelor care exprimă această enzimă vor deveni, de asemenea, luminescente, proporțional cu cantitatea de proteină luciferază pe care o sintetizează. Măsurătorile acestei luminescențe nu sunt foarte sensibile, acesta fiind cel mai probabil motivul pentru care Pfizer le-a efectuat numai pentru ficat, dar nu si pentru alte organe mai mici . Cu toate acestea, în absența unor dovezi care sa afirme contrariul, trebuie să presupunem că relatia dintre absorbția eficientă a LNP și expresia ARNm care constata pentru ficat se aplica si altor organe. Dacă ARNm codifică proteina spike, atunci aceste organe vor fi expuse toxicitatii proteinei spike și reacției imună împotriva acesteia, proporțional cu nivelul de absorbție a LNP și al ARNm.
3.1.1.7 Riscuri potențiale pentru fertilitate și pentru nou-născutul alăptat. Un nivel ridicat de expresie al proteinei spike în ovare ridica poate determina deteriorarea semnificativa a acestui organ, cu posibile consecințe pentru fertilitatea feminină. Preluarea vaccinului de către celulele glandei mamare deschide două căi posibile de toxicitate pentru copilul alăptat: primul, expresia proteinei spike și secreția ei în laptele matern și, în al doilea rând, transferul componentelor integrale ale vaccinului în lapte. Glandele mamare sunt apocrine, ceea ce înseamnă că se elimina fragmente citoplasmatice în lapte; astfel, orice a ajunge in citoplasmă ar putea ajunge și in laptele matern. În acest sens, observăm că atât baza de date VAERS, cât și Registrul UE al evenimentelor adverse medicamentoase (EudraVigilance) raportează decese la nou-născuții alăptați după vaccinarea mamelor lor (a se vedea secțiunea 3.1.3.6).
3.1.1.8 Incapacitatea Pfizer de a investiga riscurile evidentiate in investigațiile preclinice. Cu excepția fertilității, care nu putea fi evaluată în perioada scurtă de timp in care vaccinul a fost utilizat, toate riscurile mentionate mai sus au fost observate dupa lansarea vaccinurilor, toate sunt prezente în rapoartele diferitelor registre de evenimente adverse (a se vedea secțiunea 3.1.3). Trebuie să subliniem din nou că fiecare dintre aceste riscuri ar fi putut fi ușor deduse din datele preclinice limitate citate, insa acestea nu au fost insotite de investigații adecvate aprofundate. În mod particular, studiile clinice nu au monitorizat nici un parametru de laborator care ar fi putut furniza informații cu privire la aceste riscuri, cum ar fi cele legate de coagularea sângelui (de exemplu, D-dimers/trombocite) sau leziunile hepatice (de exemplu, γ-glutamiltransferază).
3.1.2 Contaminări provenite din procesul de fabricație. Procesul comercial de fabricație al BNT162b2 dă naștere mai multor contaminări care pot compromite siguranța și eficacitatea vaccinului. Pentru concizie, vom menționa aici doar doi astfel de contaminanți.
3.1.2.1 ADN bacterian contaminant. ARN-ul este produs in vitro folosind un șablon ADN , care, la rândul său, este obținut de la celule bacteriene. Desi se iau măsuri pentru eliminarea ulterioara a acestui ADN , aceste masuri nu sunt complet eficiente, ceea ce este recunoscut în raportul EMA (paginile 17 și 40). ADN-ul contaminant injectat cu vaccinul se poate insera în genomurile celulelor gazdă și poate provoca mutații potențial dăunătoare. De asemenea, ADN-ul bacterian determina în mod nespecific inflamație.
3.1.2.2 Impurități lipidice. Raportul EMA observă, de asemenea, impuritățile provenite din sinteza ingredientelor lipidice ale vaccinului (pagina 24):
Impuritățile lipidice au fost observate în unele loturi recent fabricate, corelate cu loturile lipidice ALC-0315. Calitatea excipientului ALC-0315 este considerată acceptabilă pe baza datelor disponibile, cu condiția ca impuritățile specifice din produsul finit să fie evaluate în continuare.
Având în vedere că lipidele sintetice denumite ALC-0315 nu au fost niciodată utilizate pe oameni, nu există o bază empirică solidă pentru a se stabili un nivel „acceptabile ” al impurităților. În plus, se pare că tipurile contaminante nici măcar nu au fost identificate. Aprobarea arbitrară de către EMA a contaminanților necunoscuți ale unui ingredient vaccinal este inacceptabilă.
3.1.3 Evenimente adverse după debutul vaccinărilor. De la introducerea vaccinurilor, numeroase evenimente adverse au fost raportate catre registrele de reactii adverse din întreaga lume. Ne vom concentra aici pe două registre, și anume, sistemul american de raportare a evenimentelor adverse la vaccinuri (VAERS) și sistemul de monitorizare al UE pentru evenimentele adverse ale medicamentelor (EudraVigilance). Toate valorile citate mai jos sunt din 21 mai, cu excepția cazului în care se mentioneaza altceva.
3.1.3.1 Decese raportate în legătură cu vaccinurile împotriva COVID. În doar cinci luni de la debutul vaccinării, EudraVigilance a inregistrat 12.886 de decese în legătură cu vaccinurile COVID-19 , dintre care vaccinul Pfizer a reprezentat aproape jumătate (6.306). În aceeași perioadă de timp, VAERS a inregistrat 4.406 decese; dintre acestea, 91% au fost asociate cu vaccinurile ARNm, Pfizer reprezentând 44% și Moderna 47% din total.
Este imposibil să știm ce procent dintre toate decesele care apar după vaccinare sunt raportate de fapt la VAERS sau EudraVigilance. Cu toatea cestea, este de retinut că cele 4.406 decese legate de vaccinul COVID acumulate de VAERS doar în ultimele 5 luni depășesc totalul de decese cumulate determinate toate vaccinurile combinate, pe parcursul a 20 de ani. Prin urmare, este clar că aceste vaccinuri sunt de departe cele mai mortale din istorie – lucru previzibil si sunt administrate pentru o boală a cărei rata fatalitate/cazuri nu o depășește pe cea a gripei [1, 38].
3.1.3.2 Evenimente severe legate de perturbarea coagularii sanguine. Litania diagnosticelor din ambele baze de date care indică activarea patologică a coagulării sângelui este aproape nesfârșită – infarcte miocardice, accidente vasculare cerebrale, tromboze cerebrale și în alte organe, embolii pulmonare; dar și trombocitopenie și sângerare, care rezultă din consumul excesiv de trombocite și de factori ai coagularii prin coagularea intravasculară diseminata. Aceste mecanisme au cauzat multe dintre decesele mentionate; în alte cazuri, au determinat boli acute severe, care au lasat adesea în urmă dizabilitati severe.
3.1.3.3 Alte reacții severe. Reacțiile severe includ, de asemenea, convulsii, alte simptome neurologice, în special legate de controlul motor și inflamația sistemică severă, cu leziuni ale mai multor organe. Din nou, la mulți dintre acești pacienți, afectarile de lunga durata sau reziduale permanente sunt foarte probabile.
3.1.3.4 Reacții adverse severe în rândul adolescenților. În grupa de vârstă 12-17 ani, două decese probabil legate de vaccinul Pfizer au fost deja raportate la EudraVigilance. De asemenea, în această grupă de vârstă, au existat 16 cazuri de miocardită, toate la sexul masculin și 28 de convulsii în rândul ambelor sexe, 3 dintre ele raportate ca amenintatoare de viata. Au existat, de asemenea, câteva cazuri de accidente vasculare cerebrale , infarct miocardic și boală inflamatorie severă.
Numărul evenimentelor adverse este mai mic decât în rândul adulților deoarece ratele de vaccinare sunt mult mai mici în această grupă de vârstă. Daca se va face vaccinarea sistematică si in randul adolescenților, trebuie să ne așteptăm ca aceste numere să urce rapid la nivelul la care se observă la adulți.
3.1.3.5 Avorturi spontane. La 21 iunie 2021, EudraVigilance enumeră 325 de cazuri de avort spontan în rândul femeilor gravide vaccinate. Deși este dificil să se stabilească cât de mult crește vaccinarea rata avortului spontan, majoritatea acestor cazuri a fost raportata de profesioniștii din domeniul sănătății, care, evident, au considerat plauzibila legatura cu vaccinul. Numai această serie de cazuri ar fi un motiv suficient pentru a întrerupe vaccinările și a investiga.
3.1.3.6 Decese în rândul sugarilor alăptați. Deși nu se referă direct la grupa de vârstă care se află în centrul acestui proces și la această opinie de expert, se menționează că atât VAERS, cât și EudraVigilance conțin rapoarte de deces în rândul copiilor alăptați aparute la scurt timp după ce mamele lor au primit vaccinul Pfizer.
În secțiunea 3.1.1.5, am discutat despre posibilitatea preluarii vaccinului de catre placentă și glandele mamare. Avorturile spontane raportate și decesele la nou-născuți indică faptul că aceste riscuri trebuie luate foarte în serios, insa Pfizer a acționat neglijent prin a nu le investiga în nici unul dintre studiile lor preclinice și clinice raportate .
3.2 Dovezi lipsă . Am văzut mai sus că au fost neglijate aspecte ce sugereaza riscuri semnificative în studiile clinice și, ulterior, in aprobarea de urgenta a vaccinului Pfizer, cu rezultate nefericite, dar totusi previzibile. La fel de condamnabila este lista de omisiuni – riscuri potențiale care ar fi trebuit să fie investigata, insa nu a fost, în studiile preclinice sau clinice.
3.2.1 Farmacocinetica adecvată. Sectiunea 3.1.1.2 a descris unele experimente referitoare la biodistributia unui vaccin surogat. În timp ce aceste studii au furnizat informații importante și utile, trebuie remarcat faptul că expresia proteinei spike, în loc de enzima luciferază probabil inertă, ar putea afecta biodistribuția prin interferența sa cu integritatea vasculară, inclusiv la nivelul barierei hematoencefalice, precum și cu coagularea sângelui. EMA și alte autorități de reglementare ar fi trebuit să insiste ca astfel de experimente să fie efectuate și documentate.
3.2.2 Interacțiuni medicamentoase. Raportul EMA precizează (pagina 110): „Nu au fost efectuate studii de interacțiune cu alte vaccinuri, ceea ce este acceptabil, având în vedere necesitatea utilizării vaccinului într-o situație de urgență”.
Deoarece este clar că mortalitatea cauzată de COVID-19 este scăzută (a se vedea secțiunea 1.1.1) și, prin urmare, că nu există nici o urgență, acest argument trebuie respins ca ipocrit.
Efectele imunosupresoare ale BNT162b2 sunt evidente prin scăderea numărului de limfocite sanguine în rândul celor vaccinați, precum și prin observarea aparitiei zonei zoster, prin reactivarea virusului varicelo-zosterian persistent [39]. Acest lucru sugerează că si răspunsul imun la alte vaccinuri administrate simultan poate fi afectat.
În plus, studiile privind interacțiunile nu ar fi trebuit să se limiteze doar la vaccinuri, ci ar fi trebuit sa fie efectuate si pentru medicamente. Un motiv de îngrijorare este toxicitatea hepatică experimentală a BNT162b2. Ficatul are un rol central în inactivarea metabolică și eliminarea multor medicamente; orice interferență cu funcția acestui organ creează posibilitatea de interacțiuni medicamentoase nefavorabile.
3.2.3 Genotoxicitate. Nu au fost efectuate studii privind genotoxicitatea, adică deteriorarea materialului genetic uman, ceea ce ar putea duce la mutații ereditare și cancer. În raportul EMA [30,p.50], acest lucru este justificat astfel:
Nu au fost efectuate studii de genotoxicitate. Acest lucru este acceptabil, deoarece componentele vaccinului sunt lipidele și ARN-ul, de la care nu ne așteaptăm să existe potențial genotoxic. Evaluarea riscurilor efectuate de solicitant arată că riscul de genotoxicitate legat de acești excipienți [adică lipidele sintetice] este foarte scăzut pe baza datelor din literatura de specialitate.
În realitate, se știe că LNP-urile conținute în BNT162b2 pot intra in diferite celule – acesta fiind, la urma urmei, scopul includerii lor în acest preparat vaccinal. De asemenea, se știe că, odată ajunse în interiorul celulei, lipidele cationice perturbă funcția mitocondrială (respirația celulară) și provoacă stres oxidativ, ceea ce, la rândul său, duce la deteriorarea ADN-ului .
De menționat că două dintre lipidele utilizate de Pfizer, și anume lipidele cationice ALC-0315 si lipidul PEG-ilat ALC-0159, care reprezintă 30-50% și, respectiv, 26%, din conținutul total de lipide, nu au mai fost aprobate anterior pentru utilizare la om. Atitudinile Pfizer și EMA de a utiliza substanțe chimice noi, până în prezent nedovedite ca si componente în medicamente sau vaccinuri, fără studii cuprinzătoare privind toxicitatea, inclusiv genotoxcitatea, este complet neștiințifica și inacceptabila.
3.2.4 Toxicitatea asupra reproducerii. Toxicitatea asupra funcției de reproducere a fost evaluată utilizând o singură specie (șobolani) si un număr mic de animale. S-a observat o creștere de două ori mai mare avortului preimplantational – cu o rată de 9, 77% în grupul vaccinal, comparativ cu 4,09% în grupul de control. În loc să se afirme [30, p.50] că valoarea mai mare a fost ” în intervalul istoric de date control „, studiul ar fi trebuit să precizeze fără echivoc dacă această diferență a fost sau nu semnificativă statistic; și dacă nu a fost, numărul de animale incluse in experiment ar fi trebuit să crească pentru a asigura puterea statistică necesară. Același lucru este valabil și pentru observațiile privind „incidența foarte scăzută a gastroschizisului, malformațiilor gurii / maxilarului, arcului aortic de partea dreaptă și anomaliilor vertebrelor cervicale”. În general, aceste studii sunt descrise în mod necorespunzător și se pare că au fost efectuate inadecvat.
3.2.5 Autoimunitatea. Expunerea la vaccin va duce la deteriorarea celulelor din cauza lipidelor cationice și, de asemenea, la atacul imun asupra celulelor care produc proteina spike. Din celulele distruse, vor fi eliberate proteine și alte macromolecule; astfel de materiale trebuie apoi eliminate de catre macrofage.
Când mecanismul de curatare este supraîncărcat din cauza distrugerii excesive a celulelor și a apoptozei (moartea celulelor), acumularea de resturi celulare va duce la eliberarea cronică excesivă de interferon; acest lucru, la rândul său, va declanșa inflamație suplimentară. Cu timpul, unele macromolecule din aceste resturi vor deveni ținte pentru formarea autoanticorpilor și activarea celulelor T citotoxice autoreactive, adica vor începe să funcționeze ca autoantigene. Acest lucru duce la deteriorarea suplimentara a țesuturilor și la eliberarea mai multor autoantigene, dezvoltandu-se boala autoimună. Un astfel de mecanism este foarte probabil pentru persoanele imunocompromise sau la cele care sunt predispuse genetic bolilor autoimune (de exemplu, cei cu alela HLA-B27 ).
Riscul de autoimunitate indus de BNT162b2 ar putea fi evaluat în mod adecvat numai în studiile pe termen lung ; ca și în cazul fertilității sau cancerului, perioada de testare preclinică și clinică este foarte scurtă, ceea ce înseamnă ca nu avem inca aceste date. Ar trebui sa se tina cont ca toate aceste riscuri sunt in modparticular grave la copii, adolescenți și adulții tineri.
3.2.6 Boala agravata de anticorpi (ADE). În timp ce anticorpii, servesc pentru a ne proteja de infecții, în unele cazuri, ei cresc severitatea bolii. Acest fenomen este denumit boala agravata de anticorpi.
3.2.6.1 Principiul. În secțiunea 2.1.3.1 de mai sus, am văzut că anticorpii pot sau nu să neutralizeze virusul care le-a provocat. În timp ce, în majoritatea cazurilor, anticorpii non-neutralizanți nu sunt dăunători, pentru unele virusuri pot înrăutăți lucrurile prin facilitarea intrării acestor virusuri în celulele gazdă. Acest lucru se întâmplă deoarece anumite celule ale sistemului imun ar trebui să preia virusurile acoperite de anticorpi și să le distruga. Dacă o particulă de virus de care s-au atasat anticorpii este preluată de celule, dar reușește să se sustragă distrugerii, atunci virusul poate începe să se înmulțească în această celulă. Prin acest mecanism, anticorpii vor contribui la favorizarea replicarii virusului. Din punct de vedere clinic, această boala agravata de anticorpi (ADE) poate provoca un răspuns hiperinflamator (o ” furtună de citokine „) care va accentua afectarea plămânilor, ficatului și a altor organe ale corpului nostru.
ADE poate apărea atât după infecția naturală, cât și după vaccinare și a fost observata la mai multe familii de virusuri, inclusiv virusul Dengue, virusul Ebola, virusul sincițial respirator (RSV) și HIV [40]. Important, ADE se produce de asemenea si in cazul coronavirusurilor și, în special a SARS-ului, al cărui agent cauzal este asemanator cu SARS-CoV-2. Încercările de a dezvolta vaccinuri împotriva SARS au eșuat în mod repetat din cauza ADE. Vaccinurile au indus anticorpi si, când animalele vaccinate au venit ulterior in contact cu virusul, acestea s-au îmbolnăvit mai mult decât nevaccinatii din grupul control (de exemplu, [41]).
3.2.6.2 SARS-CoV-2 și ADE. Posibilitatea ADE în contextul infecției naturale cu SARS-CoV-2, precum și al vaccinării împotriva acesteia, a fost recunoscută [42]. Mai precis, ADE cauzat de anticorpii antiproteina spike determinati de alte tulpini de coronavirus, a fost invocat pentru a explica distribuția geografică specifică a severității bolii în China [43]. Cu toate acestea, cercetarea experimentală necesară pentru a o studia lipseste, chiar și după mai mult de un an de pandemie.
Cu unele vaccinuri experimentale SARS, ADE ar putea fi atenuate prin utilizarea de adjuvanți pe bază de inulină [44]. Această abordare ar putea fi fezabilă și pentru evitarea ADE la vaccinuri covid-19, dar până în prezent acest lucru pare să nu fi fost investigat pentru niciunul dintre vaccinurile COVID existente.
Pfizer și organismele de reglementare sunt conștienți de riscul de ADE. FDA notează în documentul său de informare [29,p.44]: Pfizer a prezentat un plan de farmacovigilență (PVP) pentru a monitoriza siguranță in legatura cu administrarea vaccinului Pfizer-BioNTech COVID-19. Sponsorul a identificat boala agravata asociată vaccinului, inclusiv boala respiratorie agravata asociată vaccinului, ca fiind riscuri potențiale important.
Aici, termenul „boală agravata de vaccin” se referă la ADE. EMA a recunoscut, de asemenea, că acest risc trebuie investigat în continuare [30, p.141]: „Trebuie luate în considerare orice riscuri potențiale importante care pot fi asociate vaccinării impotriva COVID19 (de exemplu, boala respiratorie agravata de vaccin). Solicitantul a inclus VAED/VAERD ca un risc potențial important și îl va investiga în continuare în studiul pivot în curs de desfășurare și într-un studiu de siguranță postautorizare.
Îngeneral, este clar că riscul de ADE este recunoscut doar în teorie, dar nu este urmarit în practică. Având în vedere numeroasele dovezi despre ADE din studiile cu vaccinurile experimentale SARS , acest lucru este complet iresponsabil.
Referințe
[1] J. P. A. Ioannidis: Infection fatality rate of COVID-19 inferred from seroprevalence data. Bull. World Health Organ. (2020), BLT.20.265892. url: https://www.who.int/bulletin/ online_first/BLT.20.265892.pdf.
[2] J. P. A. Ioannidis: Reconciling estimates of global spread and infection fatality rates of COVID-19: An overview of systematic evaluations. Eur. J. Clin. Invest. 5 (2021), e133554. pmid: 33768536.
[3] CDC COVID-19 Response Team: Coronavirus Disease 2019 in Children – United States, February 12-April 2, 2020. MMWR. Morbidity and mortality weekly report 69 (2020), 422– 426. pmid: 32271728.
[4] S. Tsabouri et al.: Risk Factors for Severity in Children with Coronavirus Disease 2019: A Comprehensive Literature Review. Pediatric clinics of North America 68 (2021), 321–338. pmid: 33228941.
[5] J. Y. Abrams et al.: Multisystem Inflammatory Syndrome in Children Associated with Severe Acute Respiratory Syndrome Coronavirus 2: A Systematic Review. J. Pediatr. 226 (2020), 45– 54. pmid: 32768466.
[6] P. A. McCullough et al.: Multifaceted highly targeted sequential multidrug treatment of early ambulatory high-risk SARS-CoV-2 infection (COVID-19). Reviews in cardiovascular medicine 21 (2020), 517–530. pmid: 33387997.
[7] C. Bernigaud et al.: Oral ivermectin for a scabies outbreak in a long-term care facility: potential value in preventing COVID-19 and associated mortality. Br. J. Dermatol. 184 (2021), 1207–1209. pmid: 33454964.
[8] Anonymous: WHO advises that ivermectin only be used to treat COVID-19 within clinical trials. 2021. url: https://www.who.int/news-room/feature-stories/detail/whoadvises-that-ivermectin-only-be-used-to-treat-covid-19-within-clinicaltrials.
[9] J. Flood et al.: Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 (PIMS-TS): Prospective, national surveillance, United Kingdom and Ireland, 2020. The Lancet regional health. Europe 3 (2021), 100075. pmid: 34027512.
[10] N. K. Shrestha et al.: Necessity of COVID-19 vaccination in previously infected individuals. medRxiv (2021). doi: 10.1101/2021.06.01.21258176.
[11] S. S. Nielsen et al.: SARS-CoV-2 elicits robust adaptive immune responses regardless of disease severity. EBioMedicine 68 (2021), 103410. pmid: 34098342.
[12] A. Grifoni et al.: Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell 181 (2020), 1489–1501.e15. pmid: 32473127.
[13] N. Le Bert et al.: SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature 584 (2020), 457–462. pmid: 32668444.
[14] S. Cao et al.: Post-lockdown SARS-CoV-2 nucleic acid screening in nearly ten million residents of Wuhan, China. Nat. Commun. 11 (2020), 5917. pmid: 33219229.
[15] R. Wölfel et al.: Virological assessment of hospitalized patients with COVID-2019. Nature 581 (2020), 465–469. pmid: 32235945.
[16] K. Basile et al.: Cell-based culture of SARS-CoV-2 informs infectivity and safe de-isolation assessments during COVID-19. Clin. Infect. Dis. (2020). pmid: 33098412.
[17] Anonymous: Covid: Secret filming exposes contamination risk at test results lab. 2021. url:
https://www.bbc.com/news/uk-56556806.
[18] K. G. Andersen et al.: The proximal origin of SARS-CoV-2. Nat. Med. 26 (2020), 450–452. doi: 10.1038/s41591-020-0820-9.
[19] B. Sørensen et al.: Biovacc-19: A Candidate Vaccine for Covid-19 (SARS-CoV-2) Developed from Analysis of its General Method of Action for Infectivity. QRB Discovery 1 (2020). doi: 10.1017/qrd.2020.8.
[20] B. Sørensen et al.: The evidence which suggests that this is no naturally evolved virus. Preprint (2020). url: https://www.minervanett.no/files/2020/07/13/ TheEvidenceNoNaturalEvol.pdf.
[21] L. Yan et al.: Unusual Features of the SARS-CoV-2 Genome Suggesting Sophisticated Laboratory Modification Rather Than Natural Evolution and Delineation of Its Probable Synthetic Route. Preprint (2020). doi: 10.5281/zenodo.4028829.
[22] L. Yan et al.: SARS-CoV-2 Is an Unrestricted Bioweapon: A Truth Revealed through Uncovering a Large-Scale, Organized Scientific Fraud. Preprint (2020). doi: 10.5281/zenodo.
4073131.
[23] S. Yang and R. E. Rothman: PCR-based diagnostics for infectious diseases: uses, limitations, and future applications in acute-care settings. Lancet Infect. Dis. 4 (2004), 337–48. pmid:
15172342.
[24] V. M. Corman et al.: Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 25 (2020). pmid: 31992387.
[25] Anonymous: Corman-Drosten review report. 2020. url: https://cormandrostenreview.
com/.
[26] R. Jaafar et al.: Correlation Between 3790 Quantitative Polymerase Chain Reaction-Positives Samples and Positive Cell Cultures, Including 1941 Severe Acute Respiratory Syndrome Coronavirus 2 Isolates. Clin. Infect. Dis. 72 (2020), e921. pmid: 32986798.
[27] F. M. Liotti et al.: Assessment of SARS-CoV-2 RNA Test Results Among Patients Who Recovered From COVID-19 With Prior Negative Results. JAMA internal medicine 181 (2020), 702–704. pmid: 33180119.
[28] J. Bullard et al.: Predicting Infectious Severe Acute Respiratory Syndrome Coronavirus 2 From Diagnostic Samples. Clin. Infect. Dis. 71 (2020), 2663–2666. pmid: 32442256.
[29] Anonymous: FDA briefing document: Pfizer-BioNTech COVID-19 Vaccine. 2020. url: https: //www.fda.gov/media/144245/download.
[30] Anonymous: Assessment report/Comirnaty. 2021. url: https://www.ema.europa.eu/ en/documents/assessment-report/comirnaty-epar-public-assessment-report_ en.pdf.
[31] R. W. Frenck et al.: Safety, Immunogenicity, and Efficacy of the BNT162b2 Covid-19 Vaccine in Adolescents. N. Engl. J. Med. (2021). pmid: 34043894.
[32] R. A. Campbell et al.: Comparison of the coagulopathies associated with COVID-19 and sepsis. Research and practice in thrombosis and haemostasis 5 (2021), e12525. pmid: 34027292.
[33] G. H. Frydman et al.: The Potential Role of Coagulation Factor Xa in the Pathophysiology of COVID-19: A Role for Anticoagulants as Multimodal Therapeutic Agents. TH open : companion journal to thrombosis and haemostasis 4 (2020), e288–e299. pmid: 33043235.
[34] Anonymous: SARS-CoV-2 mRNA Vaccine (BNT162, PF-07302048) 2.6.4 [Summary statement of the pharmacokinetic study] (Japanese). 2020. url: https://www.pmda.go.jp/drugs/ 2021/P20210212001/672212000_30300AMX00231_I100_1.pdf.
[35] I. C. Kourtis et al.: Peripherally administered nanoparticles target monocytic myeloid cells, secondary lymphoid organs and tumors in mice. PLoS One 8 (2013), e61646. pmid: 23626707.
[36] C. Ye et al.: Co-delivery of GOLPH3 siRNA and gefitinib by cationic lipid-PLGA nanoparticles improves EGFR-targeted therapy for glioma. J. Mol. Med. Berl. 97 (2019), 1575–1588. pmid: 31673738.
[37] R. Dal Magro et al.: ApoE-modified solid lipid nanoparticles: A feasible strategy to cross the blood-brain barrier. J. Control. Release 249 (2017), 103–110. pmid: 28153761.
[38] R. B. Brown: Public health lessons learned from biases in coronavirus mortality overestimation. Disaster Med. Public Health Prep. (2020), 1–24. pmid: 32782048.
[39] V. Furer et al.: Herpes zoster following BNT162b2 mRNA Covid-19 vaccination in patients with autoimmune inflammatory rheumatic diseases: a case series. Rheumatology (2021). pmid: 33848321.
[40] S. M. C. Tirado and K.-J. Yoon: Antibody-dependent enhancement of virus infection and disease. Viral immunology 16 (2003), 69–86. pmid: 12725690.
[41] C.-T. Tseng et al.: Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS One 7 (2012), e35421. pmid:
22536382.
[42] F. Negro: Is antibody-dependent enhancement playing a role in COVID-19 pathogenesis? Swiss Med. Wkly. 150 (2020), w20249. pmid: 32298458.
[43] J. A. Tetro: Is COVID-19 receiving ADE from other coronaviruses? Microbes and infection 22 (2020), 72–73. pmid: 32092539.
[44] Y. Honda-Okubo et al.: Severe acute respiratory syndrome-associated coronavirus vaccines formulated with delta inulin adjuvants provide enhanced protection while ameliorating lung eosinophilic immunopathology. J. Virol. 89 (2015), 2995–3007. pmid: 25520500.



